اسید سولفوریک یا سولفوریک اسید (Sulfuric Acid)، اسیدی با چگالی بالا (1.84 g/cm3)، بسیار قوی و بی رنگ است و با هر درصدی در آب حل می شود. فرمول شیمیایی آن H2SO4 است و با نام های هیدروژن سولفات یا جوهر گوگرد نیز شناخته می شود.
اسید سولفوریک یا سولفوریک اسید (Sulfuric Acid)، اسیدی با چگالی بالا ( g/cm3 1.84)، بسیار قوی و بی رنگ است و با هر درصدی در آب حل می شود. فرمول شیمیایی آن H2SO4 است و با نام های هیدروژن سولفات یا جوهر گوگرد نیز شناخته می شود. این ماده یکی از مواد شیمیایی پرکاربرد در جهان است و حجم مصرف بسیار بالایی دارد. این ماده یکی از مهمترین مواد شیمیایی موجود در جهان است که از واکنش آب با سولفور تریاکسید (که خود از ترکیب سولفور دیاکسید و اکسیژن از طریق فرایند تماسی یا فرایند محفظهای بدست میآید) ساخته میشود.
در هنگام اختلاط اسید سولفوریک با سایر مواد شیمیایی یا رقیقسازی آن با آب، یک واکنش گرمازا روی میدهد. مقدار این انرژی تولیدشده به حدی است که میتواند دمای محلول را به طور قابل ملاحظهای بالا ببرد. این گرما اگر به درستی کنترل نشود، میتواند سبب آسیب به مخزن ذخیرهسازی، لوله و اتصالات و ... شود. واکنش اسید سولفوریک با آب از جمله مواردی است که همواره باید به چگونگی آن توجه داشت و از ریز به ریز نکات مربوط به آن غافل نماند. با دانستن این مووضع میتوان اقدام رقیقسازی اسید سولفوریک نمود.
چرا نباید آب را روی اسید ریخت؟
بارها در موارد مختلف این سوال به میان آمده است چرا نباید آب را بر روی اسید ریخت؟ این سوالی است که رسیدن به جواب آن در شرایطی به غیر از شرایط آزمایشگاهی، خطرناک است. دانستن این که هنگام رقیقسازی اسید، باید اسید را روی آب یا آب را روی اسید ریخت اهمیت بسیاری دارد، هرچند ممکن است بیاهمیت به نظر برسد.
هنگام رقیق سازی با آب، همیشه باید اسید به آب اضافه شود و هیچ وقت آب به اسید غلیظ اضافه نشود. زیرا اسید با آب واکنش می دهد و افزایش دمای چشمگیری اتفاق می افتد و احتمال بروز خطرات جبران ناپذیری وجود دارد. حتی در هنگام افزودن اسید به آب، افزایش دمای محلول ممکن است بیش از حد مجازِ نهایی باشد. این حد نهایی، دمایی است که آسیبدیدگی مخزن ذخیرهسازی و سایر اتصالات شروع میشود. اگر رقیق سازی اسید حتما باید انجام شود و امکان تهیۀ اسید رقیقتر وجود ندارد، بررسیهای دقیقی باید انجام شود.
نمودار بالا راهنمایی برای تعیین دمای محلول نهایی است که از رقیق سازی اسید سولفوریک با آب در دماهای مختلف حاصل می شود. این نمودار همچنین تخمینی از انرژی مورد نیاز برای از بین بردن اثرات انرژی گرمایی ناشی از واکنش نیز ارائه می دهد. لازم به ذکر است که این نمودار صرفا برای رقیق سازی اسید سولفوریک با آب کاربرد دارد.
اطلاعات مورد نیاز برای استفاده از نمودار: 1- غلظت و دمای اسید سولفوریک غلیظ 2- دمای آب مورد استفاده برای رقیق سازی
مثالی برای استفاده از این نمودار: رقیق سازی محلول 93 wt.% اسید سولفوریک 50 °C با آب 30 °Cبه منظور تهیه محلول 70 wt.% اسید سولفوریک.
تعیین دمای نهایی اسید رقیق شده: نقطه ی نشان دهنده محلول 93 wt.% اسید سولفوریک 50 °C (نقطه 1) را به آب 30 °C(نقطه 2) وصل کنید. نقطه تلاقی خط ترسیم شده با خط عمودی از درصد اسید سولفوریک نهایی، دمای اسید سولفوریک نهایی (نقطه 3) را نشان میدهد که در این مثال 150 °C است و این رقیق سازی قطعا در مخزن پلی اتیلنی نباید انجام شود.
تعیین مقدار انرژی که باید به نحوی تلف شود تا محلول به دمای نهایی مطلوب برسد: تفاوت بین نقطه ای که نشان دهنده دما و غلظت نهایی محلول است (نقطه 3)، با نقطه ای نشان دهنده غلظت نهایی محلول و دمای مطلوب (در این مثال دمای 50 °C) (نقطه 4) از روی محور عمودی (بر حسب کیلوکالری بر کیلوگرم)، مقدار انرژی مد نظر است. در این مثال این انرژی 55 kcal/kg است. (1 kcal = 4.184 kilojoule).
لازم به ذکر است که دمای نهایی مطلوب با توجه به جنس مخزن متغیر است و باید توسط تامین کننده مخزن تعیین گردد. لطفا قبل از تهیه مخزن اسیدسولفوریک، حتما با کارشناسان مجتمع پلاستیک طبرستان مشورت کرده و شرایط ذخیره سازی و رقیق سازی خود را با آن ها در میان بگذارید. همچنین برای اطلاعات بیشتر درباره ی مخازن تولید شده توسط مجتمع پلاستیک طبرستان برای مثال مخزن عمودی، مخزن نیسانی، مخزن مکعبی، مخزن قیفی، مخزن آسانرو و ... به صفحه محصولات ما سر بزنید.


 فارسی
فارسی English
English عربي
عربي کوردی
کوردی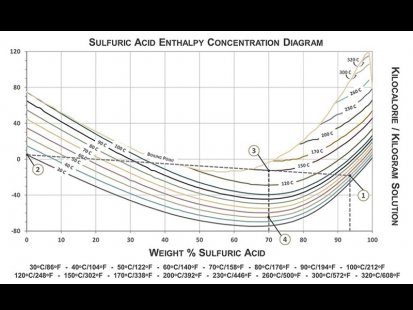
نظرات کاربران